新冠战“疫”进入第三个年头,全球怡情仍在蔓延,世界多国面临着怡情防控的严峻挑战。
截至目前,全球累计新冠肺炎确诊病例数已经超过5亿例,这距离1月初的3亿例仅过去3个月的时间。此外,3月1日-4月18日,我国31个省(自治区、直辖市)和新疆生产建设兵团累计报告本土感染者497214例,波及除西藏自治区以外的所有省份。
在新冠病毒不断变异与持续肆虐下,全球大流行至今尚未迎来“拐点”。在此形势下,疫苗作为抵御新冠病毒的首道防线,依旧是人类应对危机的最有效手段。
据国家卫健委数据显示,截至2022年4月23日,31个省(自治区、直辖市)和新疆生产建设兵团累计报告接种新冠病毒疫苗332976.6万剂次。另据牛津大学Our World in Data统计数据,截至英国伦敦时间4月21日16时(北京时间4月21日23时),全球累计报告接种新冠病毒疫苗114.9亿剂次,世界人口的65%至少接种了一剂新冠疫苗。
不过,如今完成全程疫苗接种已不足以筑牢免疫屏障,而接种加强针,成为现阶段在全球范围内,有效减少新冠重症和死亡率最有效、最可行的途径之一。4月21日,在博鳌亚洲论坛2022年年会上,国务院联防联控机制疫苗研发专班工作组组长郑忠伟也指出,随着怡情演变,两年多的实践已证明,两针不足以达到最好的保护效果,接种第三针势在必行。
早在去年10月,我国就启动了新冠疫苗加强针接种(同源加强免疫),随后在今年2月,国家卫生健康委开始部署序贯加强免疫接种(俗称“混打”)。
2月19日,国务院联防联控机制新闻发布会宣布,凡全程接种国药中生北京公司、武汉公司、北京科兴公司灭活疫苗,以及天津康希诺公司的腺病毒载体疫苗满6个月的18岁以上目标人群,可以进行一剂次同源加强免疫,也就是用原来的疫苗进行加强。序贯加强免疫策略实施后,完成全程接种上述三种灭活疫苗的目标人群,还可以选择智飞龙科马的重组蛋白疫苗或康希诺的腺病毒载体疫苗进行序贯加强免疫。
据国家卫健委通报,截至4月18日,全国累计报告接种新冠疫苗33亿1746.3万剂次,接种总人数为12亿8212万,已完成全程接种12亿4676.9万人,覆盖人数和全程接种人数分别占到全国总人口的90.94%和88.43%。完成加强免疫接种7亿3265.9万人,其中序贯加强免疫接种2542.6万人。60岁以上老年人的疫苗接种,覆盖人数达到2亿2552.1万,完成全程接种2亿1393.8万,覆盖人数和全程接种人数分别占老年人口的85.41%和81.03%。加强免疫接种已经完成1亿5487.4万人。
从数据可见,目前我国老年人新冠疫苗接种率整体偏低。这也为后续国内疫苗企业带来了发展机遇,尤其是获批序贯加强疫苗的企业。然而,随着新冠疫苗上半场竞争逐渐收尾,尽管国内疫苗接种需求巨大,由于“后来者”入局较晚,其新冠疫苗大多仍处于临床试验阶段,下半场的序贯加强之争态势如何,仍属未知。
出品|21世纪新健康研究院
撰写|21世纪新健康研究院高级研究员朱萍 实习生 胡冰月 欧阳馨月 李雯含
编辑|徐旭
设计|徐晖
第一部分:国内外怡情形势严峻复杂
当前,全球怡情形势严峻依旧,新一轮怡情向多国袭来,各国新增确诊病例不断。
根据Worldometer实时统计数据,截至北京时间2022年4月22日6时30分左右,美国累计确诊新冠肺炎病例82532355例,累计死亡病例1017449例;与前一日6时30分左右数据相比,美国新增确诊病例91023例,新增死亡病例1108例。
此外据公开报道,4月以来,美国部分政府官员及国会议员陆续确诊。当地时间4月11日,美国密歇根州众议员塔利布(Rashida Tlaib)宣布其新冠肺炎检测结果为阳性,确诊后目前正在家隔离。4月10日,美国纽约市政府发表声明称,纽约市长亚当斯当日新冠病毒检测结果呈阳性,目前未出现其他症状,已进行隔离并将取消公开活动。4月9日,美国农业部长汤姆·维尔萨克称其新冠病毒检测结果呈阳性,成为又一名确诊新冠的美国部长。4月7日,美国众议院议长佩洛西的新冠病毒检测结果呈阳性。4月6日,美国商务部长雷蒙多和司法部长加兰先后确诊感染新冠病毒。
新华社4月11日在报道中分析称,近期,美国新冠怡情看似处于平台期,但流行病学家表示,怡情数据统计不完全等因素可能使美国日增确诊病例数等指标被严重低估,使怡情上升趋势被“掩盖”。随着美国复活节、春假等假期来临,聚会增多,病毒可能加速传播,美国怡情有可能再次出现上升潮。
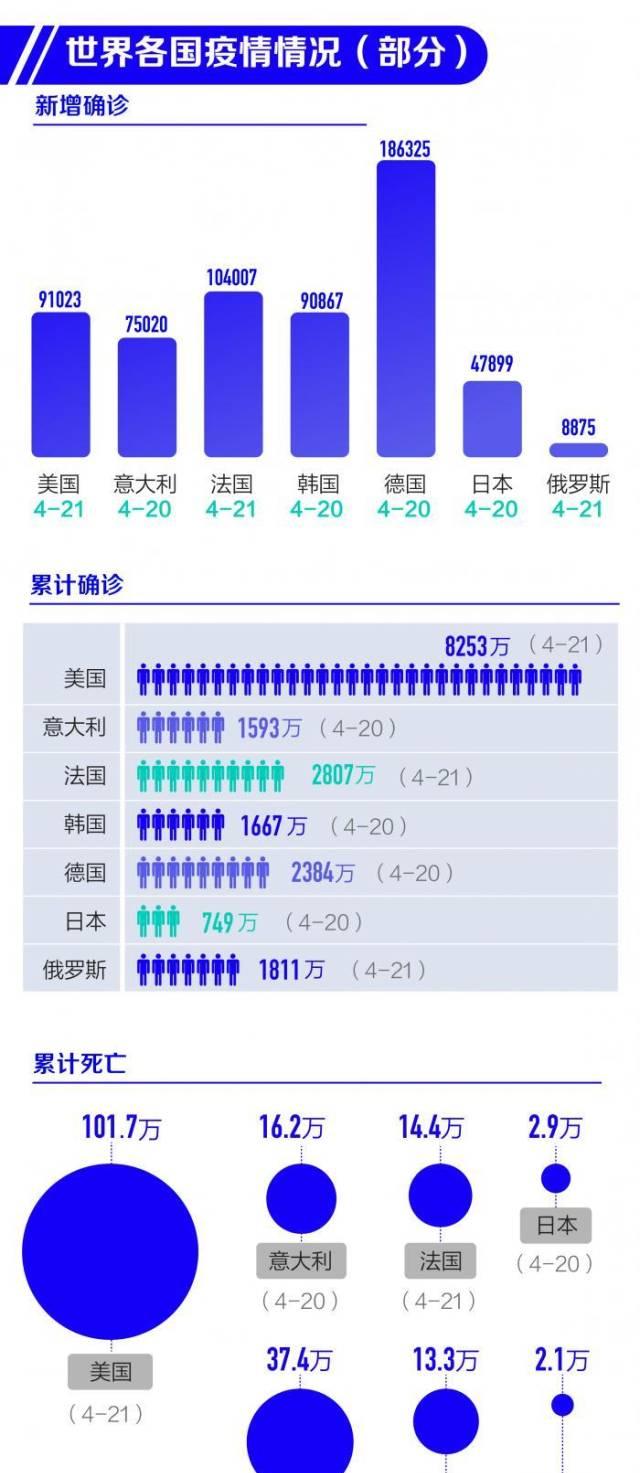
当地时间4月21日,意大利卫生部公布的最新统计数据显示,过去24小时,该国新增新冠肺炎确诊病例75020例,累计确诊病例15934437例;新增死亡病例166例,累计死亡病例162264例;新增治愈病例59916例,累计治愈病例14549360例;现存确诊病例1222813例。
新华社报道显示,3月31日,意大利结束新冠怡情导致的紧急状态,于4月1日起放宽防疫措施。民众进入银行、商店、邮局以及餐馆的户外区域等场所,或乘坐市内公共交通工具时,不再需要出示新冠“绿色通行证”。
法国公共卫生部门当地时间4月21日公布的数据显示,截至当天下午,法国累计新冠肺炎确诊病例达28076047例,24小时新增104007例。累计死亡病例达144799例,24小时新增167例。法国卫生部长奥利维耶·韦兰4月7日在接受媒体采访时介绍称,法国已经越过怡情反弹高峰。但法国公共卫生局随后呼吁谨慎,称新冠病毒仍在持续传播,目前还不能说怡情反弹峰值已经过去。
此外,据韩国中央防疫对策本部通报,截至4月21日0时,韩国较前一天0时新增感染新冠病毒确诊病例90867例,单日确诊病例较前一天减少20452例,新增死亡病例147例;累计确诊16674045例,累计死亡21667例,平均致死率为0.13%。
另据韩国媒体报道,韩国疾控部门4月19日表示,韩国首次发现2例感染新冠重组毒株XE的病例,及1例感染XM的病例。韩国疾控部门对此表示,世卫组织将XE与XM都归为奥密克戎类毒株,特性与奥密克戎原始株BA.1没有太大不同。鉴于目前尚无关于其传播力、致重症率等信息的资料,防疫部门将加强对变异株的监控工作。
韩国疾控部门4月12日表示,国内首次发现感染新冠重组毒株XL的确诊病例,正在进行流行病学调查。报道称,XL毒株是迄今发现的17种重组毒株(XA~XS)的其中之一,由“奥密克戎”原始株BA.1和亚型株BA.2重组而成。不过,目前尚无关于XL毒株传播特点的信息,此前仅在英国被发现。
海外网消息显示,韩国国务总理金富谦4月15日宣布,从4月18日起,全面解除保持社交距离的限制,室内义务戴口罩的防疫措施仍将保留。据了解,该国保持社交距离的防疫措施自2020年3月起实施,至今已有两年另一个月。另外,4月18日起,在韩国,私人聚集、大型活动集会都不再受人数限制,高风险经营场所可以24小时营业,宗教设施也不再限流。这意味着韩国在怡情防控形势严峻的背景下选择了“躺平”。
根据德国联邦疾控机构罗伯特·科赫研究所发布的最新统计数据,截至当地时间4月21日零时,德国累计新冠肺炎确诊病例达23844536例,较前一日新增186325例;累计死亡133632例,较前一日新增324例。
据央视新闻消息,法新社4月21日报道称,一名德国财政部官员表示,正在美国华盛顿参加国际货币基金组织和世界银行春季会议的德国财政部长克里斯蒂安·林德纳新冠病毒检测呈阳性。当日林德纳在社交媒体上证实了这一消息。
当地时间4月8日,德国卫生部长劳特巴赫表示,在立法者否决了拟议的第四剂疫苗任务后,德国可能需要在今年秋天重新实行在公共场合戴口罩的要求。劳特巴赫指出,此前发出的结束强制隔离的建议是出于减轻卫生当局的负担,为此发出了错误信号。但大流行并未过去,“我们每天仍有300多人死亡”,劳特巴赫在新闻发布会上强调。
目前,国内也遭受着新一轮怡情的冲击,全国不断出现散发本土怡情,单日新冠感染病例数仍处于高位。
在国务院联防联控机制4月19日新闻发布会上,据国家卫健委疾控局副局长吴良有介绍:3月1日-4月18日,31个省(自治区、直辖市)和新疆生产建设兵团累计报告本土感染者497214例,波及除西藏自治区以外的所有省份。近一段时间,全国怡情形势呈现逐渐企稳态势,但地区之间交叉输入影响明显,各地动态清零的任务十分艰巨。河北、江苏、浙江、安徽、广东、福建、辽宁等省怡情总体趋于平稳。吉林省吉林市怡情持续好转,处于下降趋势,长春市怡情呈现下降态势。上海市近日怡情仍处于高位,社区传播风险仍然较高,防控形势依然严峻,防控任务仍十分艰巨紧迫。
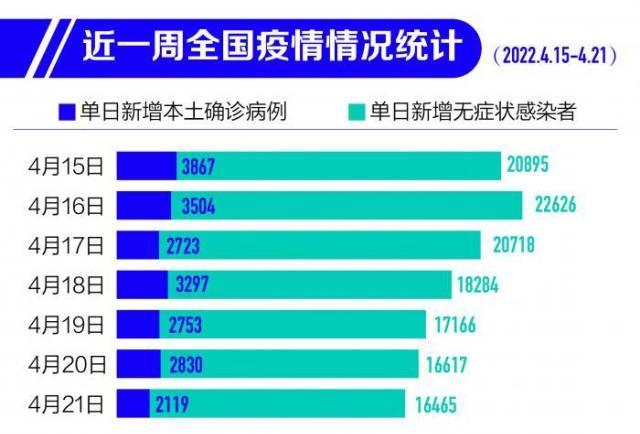
此后,4月19日-22日,国内每日新增本土确诊病例仍超2000例。4月24日0—24时,31个省(自治区、直辖市)和新疆生产建设兵团报告新增确诊病例2680例。其中本土病例2666例(上海2472例,吉林79例,黑龙江26例,北京14例,江西14例,浙江13例,湖南12例,内蒙古9例,河南5例,青海5例,江苏4例,辽宁3例,广东3例,山西2例,山东2例,天津1例,福建1例,四川1例),含899例由无症状感染者转为确诊病例(上海846例,吉林39例,浙江12例,福建1例,青海1例)。新增死亡病例51例,均为本土病例,在上海;无新增疑似病例。
本轮怡情来势凶猛,上海单日新增新冠肺炎病例首次超过万例是在4月4日。当日上海新增本土新冠肺炎感染者13354例,其中新增确诊268例,新增无症状感染者13086例。
随后,上海怡情持续处于高位运行。截至4月20日,上海本轮怡情累计感染者超过40万例。与此同时,截至4月23日24时,上海已累计报告87例死亡病例,现有重型160例,危重型19例。随后4月24日0—24时,上海新增本土死亡51例。目前本轮怡情中上海累计死亡病例破百。
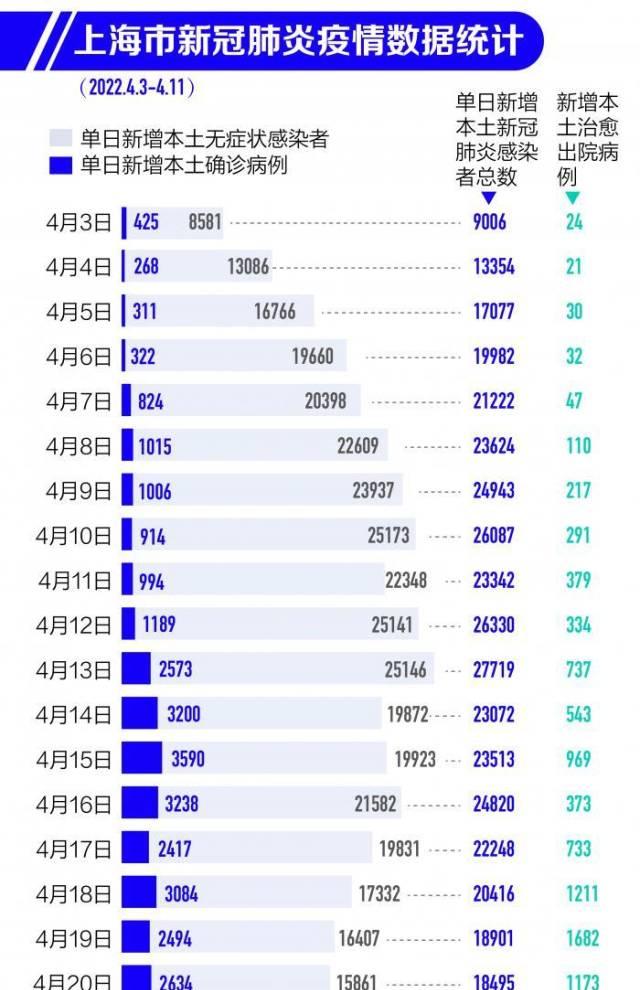
除了上海外,吉林、黑龙江等地也面临着怡情防控的挑战。3月初,吉林省暴发2022年开年后新一轮怡情,单日新增本土确诊病例由个位数到破百再到破千。经过近一个月的努力,吉林省怡情防控工作目前取得了阶段性成效,居民的生产生活秩序正逐渐恢复。
据吉林卫健委消息,4月21日0-24时,全省新增本地确诊病例63例,其中长春市53例、吉林市5例、延边州4例、白城市1例;新增本地无症状感染者244例,其中长春市211例、延边州14例、吉林市12例、白城市6例、松原市1例。4月21日,全省新增治愈出院确诊病例873例,新增解除隔离医学观察无症状感染者1141例。
4月21日上午召开的吉林省怡情防控工作新闻发布会上,吉林省卫健委党组成员耿建仁通报了该省怡情防控整体工作情况:当前,省新冠肺炎怡情防控工作取得阶段性成效,但怡情防控形势依然严峻,仍要继续坚持外防输入、内防反弹,坚持“动态清零”不犹豫、不动摇,抓实抓细怡情防控各项举措,严守不发生怡情规模性反弹底线。
黑龙江省卫健委官网显示,4月21日0-24时,该省新增新冠肺炎本土确诊病例34例(均在哈尔滨市),新增本土无症状感染者56例(均在哈尔滨市)。截至4月21日24时,全省现有本土确诊病例304例,本土无症状感染者224例;全省现有境外输入确诊病例1例,境外输入无症状感染者5例。
面对近期全国本土聚集性怡情点多、面广、频发的态势,我国怡情防控坚持“动态清零”总方针不动摇。
4月22日,国家卫健委怡情应对处置工作领导小组专家组组长、清华大学万科公共卫生与健康学院常务副院长梁万年在接受媒体采访时强调,坚持“动态清零”产生的成本和效益,要算大账、整体账、动态账。现在“动态清零”的成本,包括新冠疫苗、核酸检测、方舱建设、人力资源等投入,如同为应对风险买了一份保险。面对奥密克戎带来的风险,我国的这份保险惠及了14亿的中国人,把怡情控制住不扩散,事实上是给14亿人买保险,这些投入都是值得的。
梁万年指出,新冠怡情无论是从传播力、致病力、病死率等都远远超过流感。梁万年以香港的真实世界的数据来举例,香港人群的奥密克戎流行株平均病死率是0.75%左右,是流感的七倍到八倍。从老年人群来看的话,特别是80岁以上的老年人群,它的病死率将是普通流感的近百倍。
还有一个关键因素,就是我国老年人的新冠疫苗接种率。根据国家卫健委公布的数据,截至4月18日我国60岁以上老年人疫苗接种,覆盖人数为22552.1万,完成全程接种21393.8万,覆盖人数和全程接种人数分别占老年人口的85.41%和81.03%,加强免疫接种已经完成15487.4万人。
“我国老年人口数量巨大,目前老年人口疫苗接种率相对来说还不够高。”梁万年表示,一旦怡情管控放松,它的结局可以看得很清楚,肯定是病毒广泛地传播,老年人群的重症和死亡数量是巨大的。对于一个国家来说是一个巨大的灾难。大量重症的出现,反过来挤兑医疗系统,而且随着医务人员感染势必又会造成正常的医疗服务的需求得不到有效满足,将会形成一种恶性循环。
第二部分:序贯加强免疫接种
“近日,经国务院联防联控机制批准,国家卫生健康委已经开始部署序贯加强免疫接种。”在2月19日举行的国务院联防联控机制新闻发布会上,国家卫健委疾控局副局长吴良有表示。
对于“序贯免疫”这一概念,中国疾控中心免疫规划首席专家王华庆解释称,序贯免疫是指采用不同技术路线的疫苗,按照一定的时间间隔和一定的剂次,为了预防效果提高或者进一步降低严重不良反应风险,进行接种的一种策略。
在上述发布会上,吴良有具体介绍了目前国内序贯加强免疫的两种方案:
其一是同源加强免疫接种。此前,凡全程接种国药中生北京公司、武汉公司、北京科兴公司灭活疫苗,以及天津康希诺公司的腺病毒载体疫苗满6个月的18岁以上目标人群,可以进行一剂次同源加强免疫,也就是用原来的疫苗进行加强。此外,国务院联防联控机制还批准了深圳康泰公司和医科院生物所新冠病毒灭活疫苗的同源加强免疫接种。
其二是异源加强免疫接种。序贯加强免疫策略实施后,完成全程接种上述三种灭活疫苗的目标人群,还可以选择智飞龙科马的重组蛋白疫苗或康希诺的腺病毒载体疫苗进行序贯加强免疫。
吴良有同时指出,无论是同源加强还是序贯加强,都是在完成全程接种满6个月的18岁以上人群中实施。对于目标人群而言,选择其中一种即可。研究数据表明,同源加强免疫和序贯加强免疫,都能够进一步提高免疫效果。
其实,这并非我国首次开展序贯加强免疫。王华庆在发布会上指出,此前序贯免疫主要应用于脊髓灰质炎减毒活疫苗(即“小儿麻痹糖丸”),全程接需4剂次,前两剂次接种灭活三价脊髓灰质炎疫苗,后两剂次接种两价减毒活疫苗。
“对于变异性强又很难对付的病毒,经常采用序贯免疫的方式接种。”对于为何此时要推行序贯加强免疫接种,国务院联防联控机制科研攻关组疫苗研发专班专家组成员邵一鸣解释称,一是不同疫苗之间可以优势互补,二是不同人体质不一样,可能对某一类疫苗产生的副作用多一些,采用不同技术路线疫苗接种可以规避副反应。
自序贯免疫部署宣布后,哪些人群能够进行序贯加强免疫接种备受关注。王华庆对此表示,序贯加强免疫需满足以下条件:
第一,接种对象为18岁以上的人群;
第二,接种人群要完成2剂次的灭活疫苗接种,而且这2剂次接种的是国药中生北京公司、北京科兴公司、国药中生武汉公司的新冠病毒灭活疫苗;
第三,接种对象要全程完成2剂次的接种,序贯加强免疫接种间隔不能短于6个月;
第四,接种对象在序贯加强免疫之前没有进行过加强免疫,即没有打过第三针。
此外,王华庆还提醒说,接种时要做好个人防护,将自己的健康状况如实向接种医生反映,由接种医生判断是否有禁忌证、是否需缓种;接种疫苗后要留观30分钟,发生怀疑与疫苗接种有关的不良反应时,如持续时间较长、症状比较严重,一要向接种单位报告,二要及时就医。
自序贯免疫政策出台后,目前福建、山东、湖南、河南、重庆、成都、西安等多地已启动新冠疫苗序贯加强免疫接种。而在此次之前,国外已有类似部署与实施。中国疾控中心免疫规划首席专家王华庆指出,在美洲、欧洲、东南亚的一些国家,已经开始实施序贯加强免疫接种。
据悉,美国食品和药物管理局2021年10月20日修订了新冠疫苗紧急使用授权,允许接种者选用与此前所接种疫苗品牌不同的疫苗加强针。加拿大国家免疫咨询委员会2021年6月宣布新规定,允许混合接种新冠疫苗,以便进一步加快疫苗接种进度。韩国、英国等国已于2021年上半年就新冠疫苗序贯接种展开临床试验。
在多国实施序贯接种不久,基于现有研究数据,世卫组织2021年12月16日发布了新冠疫苗“混打”接种临时指南(以下称“指南”)。指南建议,如果第一针接种的是病毒载体疫苗,后续无论是第二剂或是加强针均可接种信使核糖核酸(mRNA)疫苗;反之亦然。如果起初接种灭活疫苗,后续可接种病毒载体疫苗或mRNA疫苗。
世卫组织表示,基于疫苗的安全性、免疫力和有效性,标准做法是接种全程使用同一厂家生产的疫苗。但考虑到疫苗可及性,可灵活搭配使用不同厂家生产的疫苗。不过,世卫组织同时也强调,只有认真考虑疫苗的供应情况及特定疫苗产品的潜在优势和风险,才能开展“混打”。
第三部分:谁是下一个序贯加强疫苗?
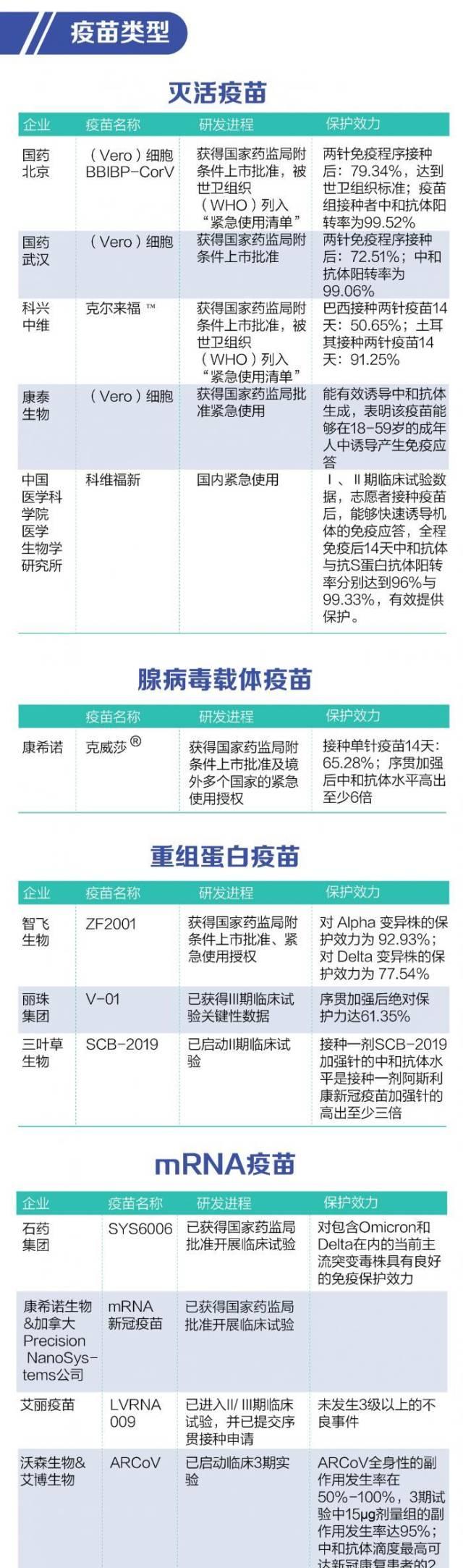
据21世纪经济报道记者统计,截至目前我国共7款新冠疫苗获批上市或紧急使用,分别为国药北京和国药武汉、科兴中维、康泰生物(300601.SZ)、中国医科院生物所的灭活疫苗,康希诺(688185.SH)的腺病毒载体疫苗,以及智飞生物(300122.SZ)的重组蛋白疫苗。目前国内主流新冠疫苗为灭活剂型,生产厂商主要包括国药北京、国药武汉、科兴中维、康泰生物、中国医科院生物所。随着序贯加强获批应用,重组蛋白疫苗生产商智飞生物(300122.SZ)、腺病毒载体疫苗生产商康希诺(688185.SH)将受益。与此同时,沃森生物的mRNA疫苗、丽珠集团的重组蛋白疫苗仍处于临床III期试验阶段。
3.1 已获批序贯疫苗的接种前景
2月19日,据国务院联防联控机制新闻发布会指出,序贯加强免疫策略实施后,完成全程接种三种灭活疫苗(国药北京、国药武汉和科兴中维灭活疫苗)的目标人群,还可以选择智飞龙科马的重组蛋白疫苗或康希诺的腺病毒载体疫苗进行序贯加强免疫。由此,康希诺生物的腺病毒载体疫苗克威莎??与智飞龙科马的重组新冠蛋白疫苗(CHO细胞)ZF2001正式获批进入序贯加强针行列。
3.1.1 康希诺生物克威莎??疫苗
2021年,康希诺联合中国工程院院士、军科院研究员陈薇团队开发的重组新型冠状病毒疫苗(5型腺病毒载体)克威莎??获得国家药监局附条件上市批准及境外多个国家的紧急使用授权。
康希诺官网显示,克威莎??采用1剂接种方案,可大大缩短接种周期,且疫苗可在2°C至8°C 之间长期稳定储运,可大幅度降低接种管理成本。据21世纪经济报道记者了解,目前康希诺产能瓶颈得以缓解,有望增加出货规模。此前康希诺仅有天津厂区产能2亿剂/年;今年1月28日,康希诺位于上海宝山工厂投产,增加2亿剂/年产能。
2021年12月,国际权威医学期刊《柳叶刀》公布了克威莎??的全球多中心Ⅲ期临床试验结果。数据显示,在18岁及以上健康人群中接种1剂克威莎??后安全、有效。14天后,重症保护率为96.0%,总体保护率为63.7%,达到世界卫生组织建议的新冠疫苗保护率标准,无一例与疫苗相关的严重不良反应发生。
自康希诺的腺病毒载体疫苗正式成为序贯加强免疫的选择之一。国金证券分析认为,克威莎??注射剂型将展开同源和交叉序贯接种,皆会增加国内市场销售。
根据2022年1月发表在BioRxiv 上的论文显示,克威莎??针对奥密克戎的中和抗体水平是灭活疫苗同源加强的6倍,重组蛋白疫苗序贯加强的3倍。而此前由江苏省疾控中心进行的临床试验数据显示,克威莎??吸入剂型用于新冠交叉加强接种,安全性与免疫原性皆优。吸入剂型加强后的14天和28天,受试者的中和抗体水平较灭活同源加强组分别高6.7-10.7倍。
据悉,克威莎??已接受世卫组织(WHO)对其提交的纳入紧急使用清单(EUL)申请后的核查。结合目前怡情形势,如果被纳入EUL,康希诺的新冠疫苗海外订单有望获得大幅增长。
3.1.2 智飞生物重组蛋白新冠疫苗“ZF2001”
此次获批的序贯加强疫苗中,重组蛋白疫苗(CHO细胞)ZF2001 (下称“ZF2001 ”)由智飞生物全资子公司智飞龙科马与中科院微生物研究所合作研发,采用重组蛋白技术路线,为首个获批的国产重组新冠病毒蛋白疫苗。
作为新冠疫苗五大技术路线之一,重组蛋白路线的疫苗产品对生产车间的生物安全等级要求低,且具备纯度高、安全性更好、能实现高产量、低成本等优势。
2021年3月,ZF2001获得国家药品监督管理局组织论证同意紧急使用,成为国内第四款获批紧急使用的新冠疫苗;同月,该疫苗在乌兹别克斯坦获得注册上市,成为国际首个注册上市的重组亚单位新冠疫苗;而今年2月,该疫苗获批作为新冠灭活疫苗的序贯(异源)加强针。3月2日,智飞生物发布公告称,公司从国家药监局官网查询获悉,重组新型冠状病毒疫苗(CHO细胞)获批附条件上市,适用于预防新冠病毒感染所致的疾病。
无论获批上市还是紧急使用,均基于该疫苗的安全性和有效性。2021年8月27日,智飞生物官方发布了重组新型冠状病毒疫苗(CHO细胞)的国际多中心III期临床试验数据。数据显示,共监测到全程接种后的主要终点病例数221 例,对于任何严重程度的COVID-19 的保护效力为81.76%,达到WHO 要求的新冠疫苗有效性标准。其中对于COVID-19 重症及以上病例、死亡病例的保护效力均为100%。根据基因分型后的初步分析结果,该疫苗对Alpha 变异株的保护效力为92.93%;对Delta 变异株的保护效力为77.54%。从安全性看,总体不良事件/反应的发生率,疫苗组与安慰剂组无显著差异,安全性良好。
3.2 潜在新冠疫苗的序贯奔赴之路
3.2.1 丽珠集团重组蛋白疫苗
V-01是丽珠集团控股附属公司珠海市丽珠单抗生物技术有限公司(“丽珠单抗”)与中国科学院生物物理研究所合作研发的创新型新冠重组蛋白疫苗,为两针接种,其抗原结构中融合了作为生物佐剂的人源干扰素,可显著增强病毒中和抗体水平,并产生有效的细胞应答。
V-01于2021年初获国家药监局批准进行临床试验,随后获批在菲律宾、巴基斯坦、俄罗斯、马来西亚等国开展序贯加强Ⅲ期临床试验。2月17日,丽珠集团(000513.SZ)发布公告称,V-01已完成序贯加强Ⅲ期临床试验的中期主数据分析,并获得了关键性数据。
根据现阶段分析试验结果,V-01序贯加强组和两针灭活疫苗组人年发病率分别为6.73%和12.80%,具有显著性差异;V-01序贯加强后的绝对保护力为61.35%,具有显著有效性,已满足WHO标准。此次试验全部有效送检标本中60个的新冠病毒基因分型一代测序均为Omicron(其余仍在进行二代测序),表明V-01序贯加强对于Omicron感染导致的COVID-19可产生良好的保护力。同时,未发现有值得关注的安全性问题。
据悉,目前V-01的生产已实现原材料国产化,原材料供应链稳定,储备充足。基于先进的分子设计,V-01佐剂采用常规铝佐剂,摆脱了蛋白类疫苗对毒副作用大且专利垄断的强佐剂的依赖,有助于促进持续稳定的产能释放。预计今年制剂产能达到15亿剂。
对于V-01的未来市场,丽珠集团方面回应称,虽然国内的新冠疫苗接种率已经很高,且部分省份已经陆续启动加强针的接种,但是面对全球变异株病毒怡情持续传播的挑战,国家整体防疫政策上也在积极支持更多技术路线疫苗的加速研发。如果丽珠V-01在国内上市,有望为未来持续加强免疫提供更多灵活科学的方案选择,为抗疫贡献一份力量。
“对于公司而言,收益固然重要,但是如果我们的疫苗能够对抗击怡情起到一定作用,社会收益比企业收益更为重要,这也是我们作为药企的责任与担当。”面对商业利益与社会效益的平衡,丽珠集团表示。
3.2.2 三叶草重组蛋白疫苗
另一潜在的重组蛋白疫苗企业为三叶草生物(02197.HK),其核心产品为重组蛋白新冠疫苗SCB-2019(CpG 1018/铝佐剂)(下称“SCB-2019”)。SCB-2019是一款三聚体重组蛋白新冠候选疫苗,运用两剂接种方案,采取肌肉注射的方式,目前临床试验已达到疫苗保护效力的主要终点及次要终点。
近日,三叶草生物发布公告表示,1月21日《柳叶刀》刊登了SCB-2019的最终保护效力数据。研究显示,接种两剂SCB-2019可对重组新冠病毒(SAR-CoV-2)变异株造成任何严重程度的COVID-19提供显著保护效力。预防任何毒株引起的重度和需住院治疗的新冠肺炎(COVID-19)保护效力为100%,预防任何毒株引起的中度至重度新冠肺炎的保护效力为83.7%,预防任何毒株引起的任何严重程度的新冠肺炎的保护效力为67.2%。从病毒变种看,预防因三种主要变种引起的任何严重程度COVID-19的疫苗效力分别为78.7%(德尔塔变种)、91.8%(伽马变种)及58.6%(缪变种)。效力分析的随访期间并未出现安全问题,各组发生不良事件的比率相当。
在序贯加强的部署背景下,SCB-2019的异源加强试验也取得了初步数据。巴西开展的一项2期临床试验初步显示,在既往已接种两剂阿斯利康疫苗的个体中,接种一剂SCB-2019加强针的中和抗体水平是接种一剂阿斯利康新冠疫苗加强针的高出至少三倍。此外,同源加强的试验数据也即将出炉。据三叶草发布的公告,SPECTRA试验于2022年1月修订后,开始将SCB-2019作为同源加强剂进行评估试验。II期临床试验2021年11月在巴西开始,初步结果预计于2022年上半年发布。
从产能看,三叶草生物规划新冠疫苗年产量达10亿剂,。公告显示,三叶草生物旗下公司已与联合国儿童基金会(UNICEF)签订长期疫苗供应协议,约定2022年向COVAX“新冠肺炎疫苗实施计划”提供4.14亿剂SCB-2019疫苗。
三叶草方面表示,预计于2022年中完成向国家药监局的注册申请,并于2022 年第三季度完成向世界卫生组织及欧洲药品管理局的注册申请,一旦获得附条件批准,就启动SCB-2019产品上市。
3.3 国产mRNA新冠疫苗加速度
mRNA疫苗作为一种新型的疫苗技术,与减毒或灭活疫苗不同,mRNA只表达特定抗原并定向诱导免疫反应。此外,它促进体液和细胞免疫反应,并诱导先天免疫系统。与DNA疫苗相比,mRNA更安全有效,因为表达不需要进入细胞核,随机基因组整合的概率几乎为零。此外,mRNA在细胞中会在较短时间内(2-3天)降解,并且开发周期短且具有广谱性。而且,通过工程化改造mRNA疫苗可大大增加其稳定性及免疫效力。
所以,目前,mRNA新冠疫苗在国际的认可度较高。不少研究数据也证实了mRNA疫苗更具优势。
近一年以来,mRNA疫苗技术路线的优势及其在应对全球新冠怡情中的突出优势,成为我国医药公司研发新冠疫苗的重心。不少企业开始研发mRNA新冠疫苗,从艾博生物和艾美疫苗再到如今获得临床试验批准的石药集团和康希诺,我国mRNA疫苗研发的势头迅猛。
3.3.1 石药集团和康希诺mRNA疫苗获批临床
2022年4月3日至4日,两款mRNA疫苗接连获得国家药品监督管理局颁发的临床试验批准文件,分别是石药集团自主研发的SYS6006和康希诺与加拿大Precision NanoSystems公司共同研制的新型冠状病毒mRNA疫苗。
这两款mRNA疫苗临床前研究结果均显示:针对当前主流突变毒株的免疫保护效力,可以更有效地保护机体免受现有变异株的感染。这意味着,这两款新的mRNA疫苗在抗击Omicron新冠肺炎中可以发挥重要的作用。
石药集团研发的mRNA新冠疫苗SYS6006是特别针对新型冠状病毒变异毒株而自主研发的,其临床前研究表明,该产品对包含Omicron和Delta在内的当前主流突变毒株具有良好的免疫保护效力;通过体液免疫和细胞免疫对机体提供免疫保护,并可产生记忆性B细胞,提供长效保护效力。
此外,石药集团还表示,临床前安全性评价数据也充分证明了该产品的安全性。该产品使用先进的生产技术,工艺过程高度可控,批间一致性好,容易实现放大和产业化;而且稳定性好,可在2℃-8℃之间长期储藏。本集团对mRNA技术的关键生产原料和辅料实现了内化生产和国产化替代,可满足大规模产能供应需求。
康希诺研发的疫苗也是针对现有变异株具有更好保护效果。其临床前研究结果显示,该款疫苗可以诱导出针对多种世界卫生组织(WHO)认定的重要变异株(包括当前流行株奥密克戎)的高滴度中和抗体,广谱性更强,可以更有效地保护机体免受现有变异株的感染。
同时,康希诺生物表示未来将充分依托包括病毒载体技术、mRNA 技术在内的核心技术平台,持续开展针对性疫苗的研究与开发。
3.3.2 艾丽疫苗mRNA新冠疫苗已进入II/ III期临床试验
新型冠状病毒mRNA疫苗LVRNA009是艾美疫苗自主研发,并在2021年3月获得国家药监局批准开展临床试验,是继艾博生物和斯微生物之后的第三款获批临床试验的国产mRNA新冠疫苗。目前,LVRNA009已进入II/ III期临床试验,并已提交序贯接种申请。
2022年1月8日,艾美疫苗I期临床试验数据显示安全性和耐受性结果良好。LVRNA009所有总的不良事件发生的级别都是在1-2级,没有发生3级以上的不良事件;也没有发生SAE和特别关注的征集性的不良事件。整个试验期间,没有发生三级以上的发热的情况。
具体来看,活病毒中和抗体检测结果显示,该疫苗的活病毒中和抗体几何平均滴度(GMT)为,“成人低剂量组第56天的GMT为570多,成人中剂量组第56天的GMT为1500多,成人高剂量组第56天的GMT为840多”。相比同类产品的I期临床试验结果,显示出非常好的安全性和免疫原性。
除了安全性和免疫原性外,LVRNA009对保存温度的要求并不“苛刻”。据了解,该疫苗可在2℃~8℃的条件下保存1个月,在-20℃的条件下保存12个月。
从产业化方面,据悉艾美疫苗目前正在多地布局mRNA疫苗的模块化生产车间,计划2022年6月份能够进行mRNA新冠疫苗工程批生产。另外,在上海、北京等地,艾美疫苗拟新建工厂,预计今年底可建成,明年投产,预计年产能达4亿剂。
此外,艾美疫苗还有一款新型冠状病毒Delta变异株mRNA疫苗在研,处于临床前阶段。
3.3.3沃森生物&艾博生物3期临床试验基本结束
mRNA新冠疫苗ARCoV(下称“ARCoV”)由中国军事医学科学院(AMMS)、艾博生物、沃森生物共同研制,目前已完成1期、2期临床研究,3期临床试验基本结束,已进入相关数据清理阶段。
2021年11月,沃森生物获批在广西和云南开展18岁以上人群的“新冠灭活疫苗 新冠mRNA疫苗”序贯接种临床试验。目前上述临床试验已完成入组接种。今年1月24日,国际权威医学期刊柳叶刀子刊《Lancet Microbe》在线刊登了ARCoV疫苗的一期临床试验结果。结果显示,ARCoV在5种不同剂量(5ug、10ug、15ug、20ug、25ug)下均安全性和耐受性良好,且能够诱导强烈的体液和细胞免疫反应,其中15ug试验组诱导的中和抗体滴度最高,大约是新冠康复患者的2倍。
ARCoV稳定性较高,可及性有所增强,可在正常冰箱温度下(2-8℃)长期保持稳定(至少6个月)。相比之下,Moderna的mRNA疫苗需要在-20℃下保存和运输(在2-8℃稳定30天),而辉瑞mRNA疫苗需要在-70℃下保存和运输运输(在2-8℃稳定5天)。
不过同样值得关注的是,ARCoV全身性的副作用发生率在50%-100%,3期试验中15??g剂量组的副作用发生率也高达95%。
据沃森生物3月21日披露,目前,新冠mRNA疫苗国内三期临床的现场工作基本结束,正在进行数据整理和持续血清检测,国际多中心三期临床试验也已取得了阶段性进展,已经在开展病例收集的工作,并持续与当地药监部门保持沟通。
第四部分:谁有望赢得下半场?
由于获批上市较早,国药中生、科兴中维等成为新冠疫苗“上半场”的受益者。其中,国药北京和国药武汉的新冠病毒灭活疫苗分别于2020年12月30日和2021年2月25日在国内附条件上市。2020年6月,国家批准科兴新冠疫苗纳入紧急使用。2021年2月5日,国家药监局依法批准科兴新冠疫苗在国内附条件上市。
据“中国生物”官方微信公众号发文,截至2021年11月16日,国药中生已累计向国内外生产供应新冠疫苗近25亿剂次,年产能已超过70亿剂次。截至目前,中国生物新冠疫苗已在全球10个国家注册上市,112个国家、地区及国际组织批准紧急使用或市场准入。
除国药外,位于新冠疫苗第一梯队的还有科兴中维。财报显示,2021年上半年科兴中维销售额为110亿美元(约700亿元),净利润为86亿美元(约540亿元)。其业绩暴涨主要来源为自主研制的新冠病毒灭活疫苗克尔来福(CoronaVac)。此外,据中国生物制药披露的财报显示,2021年其应占联营公司溢利达136.3亿元,同比暴增47倍。财报特别提到,国产新冠疫苗厂商科兴中维在联营公司中的表现“尤为突出”。由此,不少投资者根据中国生物制药在科兴中维的持股比例,推算出科兴中维2021年的净利润或超过900亿元。
据科兴中维副总经理廉晓娟去年11月18日公开透露,科兴中维已经向全球供应22亿剂新冠疫苗,其中13亿剂供应国内市场,另外9亿剂供应国际市场。2021年6月1日,中国科兴新冠疫苗被纳入WHO的紧急使用清单。截至2022年1月29日,科兴已向全球供应了27亿剂新冠疫苗,占全球新冠疫苗供应总量的23%。
目前,科兴新冠疫苗总体年产能超20亿剂,已获得60个国家、地区和国际组织的紧急使用授权或附条件上市。
不过,中信证券医药首席分析师陈竹向21世纪经济报道记者表示,新冠疫苗的竞争必定进入下半场,最大赢家很可能是(国药)中生集团,因为其本身有灭活疫苗,重组蛋白疫苗和mRA疫苗也在快马加鞭地入场,是疫苗种类最全的“国家队”。
借助新冠疫苗的红利,另外三家A股上市公司的在销产品业绩迅速增长的同时,不得不直面同行竞争。根据新发布的业绩快报,2021年安徽龙科马的母公司智飞生物(300122.SZ)实现营收306.37亿元,同比增长101.68%;实现归母净利润101.97亿元,同比增长208.88%。根据上半年的新冠疫苗业绩贡献占比推算,公司全年新冠疫苗的收入和净利润分别约为110亿、70亿元。在新冠疫苗的贡献下,康希诺生物(688185.SH)也一举扭亏为盈。业绩报告显示,2021年营收近43亿元,同比增长171倍,实现净利润19.1亿元。而根据年度业绩预告,康泰生物(300601.SZ)2021年归母净利润规模至少超过12亿元,预计同比增幅最高达到106.13%。
然而,面对受限于自身产能、研发上市进程、市场竞争激烈等因素,三家企业的市场份额仍不及国药、科兴等“先行者”。
不过,陈竹指出,与怡情暴发初期相比,疫苗接种需求和热度肯定有所下降,但像流感一样,每年可能存在重复接种的概率。
目前看来,上半场的新冠疫苗市场已被占据八九。随着序贯加强免疫接种推进,国内后发的新冠疫苗企业在加快步伐进入序贯加强的竞争赛道。不过由于“入场”较晚,大多仍处于临床试验阶段,其疫苗获批上市的时间仍是未知。再加上受到产品管线、自身产能、同行竞争等因素影响,在新冠疫苗的后半场之争中能否胜出,仍值得期待。
(来源:21世纪经济报道)